Диаграмма состояния двойных сплавов с неограниченной растворимостью компонентов в твердом состоянии. Правила определения концентраций и количественного соотношения фаз. Явление дендритной ликвации.
Полная взаимная растворимость в твердом состоянии возможна тогда, когда оба компонента имеют одинаковые кристаллические решетки и атомные диаметры компонентов мало отличаются по размерам. Такая диаграмма (рис. 4.3) имеет простой вид и состоит из двух линий — ликвидус и солидус, пересекающихся между собой в точках кристаллизации чистых компонентов А и В. Все сплавы затвердевают в некотором интервале температур (С = 1). Диаграммы такого типа имеют системы Ni-Cu, Ag-Au, Mo-V, Mo-W и др.
Рассмотрим затвердевание одного из сплавов этой системы состава xc (см. рис. 4.3). Жидкий раствор при температуре t1 начинает кристаллизоваться. Можно предполагать, что выпадающие кристаллы должны быть того же состава, что и жидкость. Однако из жидкого раствора состава хс при температуре t1 начинают выпадать кристаллы, сильно обогащенные более тугоплавким компонентом В. При дальнейшем охлаждении до температуры t2 в равновесии с жидкостью состава ха, обогащенной компонентом А, будут находиться кристаллы твердого раствора состава xb. При медленном охлаждении, а это необходимое условие для получения равновесных состояний, компонент А из жидкости диффундирует в кристаллы состава хе, и они изменяют состав до xb. К концу затвердевания при температуре все кристаллы будут иметь одинаковый состав хc.
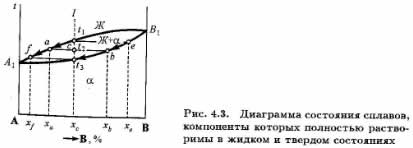
На диаграмме утолщенными линиями показано, кал изменяется состав жидкого и твердого растворов в процессе кристаллизации от температуры t1 до t3. В процессе кристаллизации изменяется не только состав, но и количественное соотношение жилкой и твердой фаз.
После окончания кристаллизации должна наблюдаться однофазная структура.
Если процесс кристаллизации протекает в условиях ускоренного охлаждения, что обычно имеет место при получении литых деталей и слитков, то диффузионное выравнивание состава у кристаллов, выпавших при температурах выше t3, не успевает происходить, в результате чего получается неодинаковый состав не только у отдельных кристаллов, а в каждом из них. Внутренние участки кристалла будут более богаты тугоплавким компонентом В, наружные - компонентом А. Это явление неоднородности химическою состава носит название микроликвации. Первые кристаллы поверхности слитка будут обогащены компонентом В, а последние, образовавшиеся в середине слитка, — компонентом А. В результате этого возникает мокроликвация в слитке.
Ликвация чаще всего играет отрицательную роль и особенно в тех случаях, когда вредные примеси распределяются неравномерно. Повышенное содержание вредных примесей может привести к преждевременному разрушению деталей.
Имея диаграмму состояния, можно проследить за фазовыми превращениями любого сплава и указать состав и количественное соотношение фаз при любой температуре. Это осуществляется при помощи двух простых правил.
Ранее указывалось, что химический состав выделяющихся кристаллов по мере снижения температуры изменяется по линии солидус от xe до хc (см. рис. 4.3). В это же время состав жидкой фазы изменяется по линии ликвидус от хс до xf. Это дает основание сформулировать правила определения состава фаз (правило концентраций) и количественного соотношения фаз (просило отрезкой). Для определения концентрации компонентов в двух фазах через данную точку (см. рис. 4.3), характеризующую состояние сплава, проводят горизонтальную линию (коноду) до пересечения с линиями, ограничивающими данную область; проекции точек пересечения (а и b) на горизонтальную ось диаграммы покажут составы фаз (xa и xb). Отрезки этой линии (коноды) между точкой с и точками а и b, определяющими составы фаз, обратно пропорциональны количествам этих фаз: Жа/ab = bс/ас.
Эти правила справедливы для любой двухфазной области диаграммы состояния и не имеют смысла в однофазной области. Используя их и привлекая еще дополнительно правило фаз, можно «прочитать» любую сложную диаграмму, состоящую из большого числа ветвей и областей.
